鲁科版(2019)化学必修第一册《硫的转化》物质的性质与转化PPT(第2课时硫酸酸雨及其防治)
展开
《硫的转化》物质的性质与转化PPT(第2课时硫酸酸雨及其防治)
第一部分内容:素养目标
1.通过不同价态硫元素之间的相互转化,认识硫单质、二氧化硫、浓硫酸的性质,能从宏观和微观相结合的视角认识它们之间的转化。
2.能通过实验探究和交流研讨,掌握硫酸的性质、典型实验现象,能书写主要的化学方程式和离子方程式。能主动进行交流,逐步提升科学探究与创新意识。
3.能从物质类别和元素价态两个视角研究物质性质并知道含硫物质在生产、生活中的应用,知道酸雨及其防治方法,提升科学态度与社会责任。
... ... ...
硫的转化PPT,第二部分内容:课前自主预习
知识铺垫
1.硫元素常见化合价为-2价、0价、+4价、+6价,单质硫既有氧化性又有还原性。如反应S+O2 SO2中,S表现还原性,S+Fe FeS中,S表现氧化性,3S+6NaOH Na2SO3+2Na2S+3H2O,S既表现氧化性又表现还原性。
2.SO2被氧化可得SO32SO2+O2 2SO3,SO3与水反应可得硫酸SO3+H2O H2SO4,硫酸具有酸的通性。
新知预习
一、实验室里研究不同价态硫元素间的转化
二、硫酸
1.物理性质
纯硫酸是无色、黏稠、油状液体,沸点高、难挥发。常用的浓硫酸质量分数是98.3%,密度比水的大。浓硫酸溶于水时放出大量的热。
2.浓硫酸的特性
浓硫酸有三大特性:吸水性、脱水性和强氧化性。
(1)浓硫酸的吸水性:浓硫酸的吸水性是指把物质本身中游离的H2O分子或结晶水吸收。例如用浓硫酸作干燥剂,就体现了其吸水性。
(2)浓硫酸的脱水性:浓硫酸能从一些有机物中将氢、氧两元素按H2O的组成(氢原子∶氧原子=2∶1)脱去。
例如浓硫酸能使火柴棒、纸张变黑,就体现了其脱水性。
(3)浓硫酸的强氧化性:与不活泼金属或非金属反应。
常温下,冷的浓硫酸能使Fe和Al的表面形成一层致密的氧化物保护膜,阻止了内部金属与H2SO4反应,这种现象叫钝化。
3.硫酸的工业生产,接触法制硫酸
(1)原料:硫黄或黄铁矿(FeS2)、空气、98.3%的浓硫酸。
(2)主要化学反应:S+O2 SO2或4FeS2+11O2 2Fe2O3+8SO2、2SO2+O2 2SO3、SO3+H2O H2SO4。
三、酸雨及防治
1.酸雨的形成
硫的氧化物是形成酸雨的主要物质。含硫燃料燃烧排放的SO2在氧气和水蒸气的共同作用下形成酸雾,随雨水降落就成为酸雨。这样所形成的酸雨也叫硫酸型酸雨。主要反应如下:
2.酸雨的危害很大,能直接破坏森林、草原和农作物,使土壤酸性增强,使湖泊酸化,还会加速建筑物、桥梁、工业设备等的腐蚀。
3.酸雨的防治
(1)严格规定污染物的排放标准。
(2)开发清洁能源。
【微思考1】浓硫酸能使蓝色胆矾变为白色,该过程体现了浓硫酸的脱水性还是吸水性?
提示:体现了吸水性,浓硫酸的吸水性是指浓硫酸吸收现成的水分子(如气体、液体中的水分子,吸收固体中的结晶水等);而脱水性是指浓硫酸可将有机物中的氢原子和氧原子按2∶1的比例脱出来,H和O原来不是以水分子的形式存在。
【微思考2】pH小于7的降水是酸雨吗?
提示:不一定。正常雨水由于溶解了CO2,pH为5.6,把pH小于5.6的降水称酸雨,收集到的酸雨样品,放置一段时间后,酸性会增强,是因为有一部分H2SO3转变为H2SO4。
自主测试
1.下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
答案:D
解析:浓硫酸使蔗糖炭化,体现的是脱水性而不是吸水性,脱水性和吸水性的本质区别是看氢和氧两元素在原物质中是否是以H2O的形式存在。浓硫酸与铜的反应需在加热的条件下进行。浓硫酸作为干燥剂,不能干燥碱性和强还原性气体,氨气不能用浓硫酸干燥而氢气可以。浓硫酸使铁铝钝化必须强调在常温下。
2.判断正误(正确的打“√”,错误的打“×”)。
(1)用稀硫酸清洗锅炉中的水垢。( )
(2)用BaCl2溶液鉴别SO42-和SO32-。( )
(3)浓硫酸具有强氧化性,所以浓硫酸可用于干燥H2和CO。( )
(4)浓硫酸使蓝矾(CuSO4·5H2O)变成白色粉末,体现了浓硫酸的强氧化性。( )
(5)50 mL 18.4 mol·L-1浓硫酸与足量铜反应,生成SO2分子的数目为0.46NA。( )
(6)向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42-。( )
答案:(1)× (2)× (3)× (4)× (5)× (6)×
... ... ...
硫的转化PPT,第三部分内容:课堂篇探究学习
浓硫酸的强氧化性和____的检验
问题探究
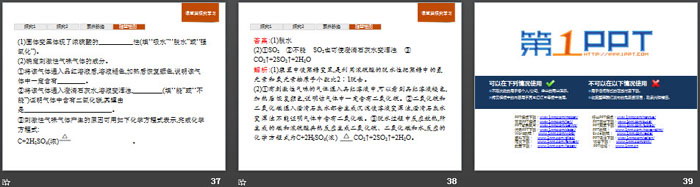
浓硫酸与足量铜在加热条件下反应时,被还原的硫酸与硫酸的总物质的量有什么关系?
提示:浓硫酸与铜反应时,由化学方程式2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O可得,被还原的硫酸占反应的硫酸的二分之一,但铜足量时,随着反应的进行,硫酸浓度变小,稀硫酸不能再与铜反应,所以,被还原的硫酸比硫酸的总物质的量的一半要少。
知识归纳
1.浓硫酸的强氧化性
(1)Fe、Al的钝化
常温下,Fe、Al遇到浓硫酸会反应生成一层致密的氧化膜而出现“钝化”现象。
(2)与氢之前的活泼金属反应
Zn+2H2SO4(浓) === ZnSO4+SO2↑+2H2O。
规律:①浓硫酸既表现氧化性,又表现酸性;②浓硫酸变稀之后发生反应Zn+H2SO4 === ZnSO4+H2↑。
(3)与氢之后的不活泼金属(除Au、Pt外)反应
规律:①反应需加热,否则不反应;②氧化产物是硫酸盐,金属显高价,还原产物为SO2;③浓硫酸既表现氧化性,又表现酸性;④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就会停止。
(4)与非金属反应
规律:①反应需要加热,否则不反应;②氧化产物是含氧酸或非金属氧化物;还原产物为SO2;③浓硫酸只表现氧化性;④随反应进行,硫酸浓度变小,为稀硫酸后反应就停止;⑤不能氧化H2、N2、O2、Si、Cl2、F2、Br2等。
2.②CO_3^2"-" 、SO_3^2"-" 、PO_4^3"-" 干扰:的检验
(1)正确操作
(2)杂质离子的干扰
①Ag+干扰:
盐酸酸化能防止Ag+干扰,因为Ag++Cl-AgCl↓。
因为BaCO3、BaSO3、Ba3(PO4)2也是白色沉淀,与BaSO4白色沉淀所不同的是这些沉淀能溶于强酸中(如BaCO3+2H+ === H2O+CO2↑+Ba2+)。因此检验__时,必须用酸酸化(一般用盐酸而不能用HNO3酸化)。
(3)钡盐的选择
... ... ...
硫的转化PPT,第四部分内容:随堂检测
1.下列对浓硫酸的叙述正确的是( )
A.常温下,浓硫酸与铁、铝不反应
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸可作H2、NH3等气体的干燥剂,表现脱水性
D.浓硫酸和铜片加热时发生反应,表现酸性和氧化性
答案:D
解析:常温下浓硫酸与铁、铝发生钝化,是浓硫酸的强氧化性使铁、铝表面形成一薄层致密的氧化膜而阻止反应进行,A项错误;浓硫酸使蔗糖炭化体现其脱水性,B项错误;浓硫酸不能干燥NH3,浓硫酸可作H2的干燥剂体现其吸水性,C项错误;浓硫酸和铜片加热时发生反应生成硫酸铜表现酸性,生成二氧化硫表现氧化性,D项正确。
2.下列有关环境污染的说法中正确的是( )
A.二氧化碳能引起温室效应,是一种大气污染物
B.显酸性的雨水称之为酸雨
C.燃煤时加入适量石灰石,可减少废气中SO2的量
D.酸雨只会使自然界的水质变酸,但不会腐蚀建筑物
答案:C
解析:温室效应主要是指由于人类向大气中大量排放二氧化碳等气体,增强了大气对红外线的吸收,阻止地球表面的热量向外散发,使地球表面的温度上升而形成,但二氧化碳未列入大气污染物,故A项错误;酸雨的pH小于5.6,是由于空气中含有大量二氧化硫或氮氧化物所致,故B项错误;燃煤时加入适量石灰石,高温下石灰石分解生成氧化钙,可与二氧化硫以及氧气反应生成硫酸钙,可大大减少废气中SO2的量,故C项正确;酸雨也会腐蚀建筑,故D项错误。
3.在如图所示的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是( )
A.①中苹果块会干瘪
B.②中胆矾晶体表面有“白斑”
C.③中小试管内有晶体析出
D.④中pH试纸变红
答案:D
解析:浓硫酸具有吸水性,故苹果块的水分和胆矾晶体的结晶水以及饱和硝酸钾溶液中的水会被吸收,A、B、C项均正确;pH试纸在浓硫酸中会被脱水炭化,应变黑,D项错误。
... ... ...
关键词:鲁科版高中化学必修一PPT课件免费下载,硫的转化PPT下载,物质的性质与转化PPT下载,硫酸酸雨及其防治PPT下载,.PPT格式;