人教版(2019)化学必修第二册《硫及其化合物》化工生产中的重要非金属元素PPT课件(第1课时硫和二氧化硫)
展开
《硫及其化合物》化工生产中的重要非金属元素PPT课件(第1课时硫和二氧化硫)
第一部分内容:核心素养发展目标
1.能从物质类别和硫元素化合价的角度认识硫和二氧化硫的性质,强化“证据推理与模型认知”能力的发展。
2.了解二氧化硫与水反应的可逆性,二氧化硫的漂白性及其与氯气漂白原理的不同。
... ... ...
硫及其化合物PPT,第二部分内容:01硫及其单质
知识梳理
1.硫——重要的非金属元素
(1)硫位于元素周期表中的第____周期第____族,硫原子最外层有____个电子,在化学反应中容易____电子,形成____价硫的化合物。
(2)硫元素的原子半径比氯原子半径____,硫原子得电子能力比氯原子____,硫化氢的稳定性比氯化氢____。
(3)硫元素的非金属性比氧元素____,在富含氧气的地表附近的含硫化合物中,硫常显____价,氧为____价。
2.硫单质
(1)物理性质
①单质硫俗称____,是一种____晶体,质脆,易研成粉末。
②难溶于水,微溶于________,易溶于________。
归纳总结
(1)从物质类别和元素化合价角度理解硫的化学性质:
(2)硫在一定条件下与大多数金属反应生成相应的金属硫化物,与变价金属反应生成其低价金属硫化物。
(3)硫与氧气反应,不论氧气是否足量、浓度如何,其一步反应都只能生成SO2,不能生成SO3。
深度思考
1.根据硫的性质,回答下列问题:
(1)单质间发生化合反应,能否生成Fe2S3或CuS?
提示 不能。单质硫与变价金属铁或铜化合只能生成FeS或Cu2S。
(2)铁与硫反应生成FeS,与氯气反应生成FeCl3,能否说明氯气的氧化性比硫强?
提示 能。氯气将铁氧化为+3价,而硫只能将铁氧化为+2价。
2.硫与热碱液反应生成金属硫化物和亚硫酸盐。如3S+6NaOH==2Na2S+Na2SO3+3H2O。
(1)该反应中硫体现的性质是________________。
(2)氧化剂与还原剂的物质的量之比为_____。
(3)试管内壁上附有硫单质时,能否用酒精洗涤,如不能,用什么洗涤?(从硫的物理性质及化学性质两个角度分析)
相关链接
硫与银、汞的反应及其应用
一般说来,S不能使具有可变化合价的金属显高价,且S与大多数金属的反应需在加热条件下才能完成,但是S与Hg、Ag等不活泼金属的反应在常温下就能进行,且能使Hg显高价。
①利用Ag和S的反应可以鉴别出真假银:用一布条沾上少量硫黄粉末在待鉴别的器皿表面用力摩擦,若摩擦处出现黑斑则说明是真银,否则为假银。
②利用Hg和S的反应可以消除温度计、气压计、血压计等被打破后汞的毒害,所以若汞不慎洒落在地面上,要立即打开门窗通风,并尽量设法收集起来,残余的部分可覆盖硫粉处理,以免汞蒸气中毒。
跟踪强化
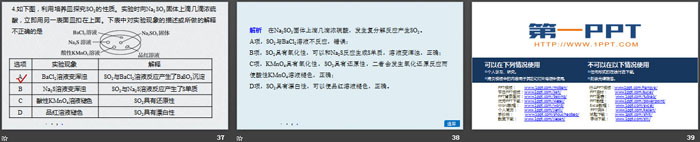
1.下列说法不正确的是
A.硫是一种难溶于水的黄色固体
B.硫与铁反应生成硫化亚铁
C.单质硫既有氧化性,又有还原性
D.硫在过量纯氧中的燃烧产物是三氧化硫
2.下列物质中,不能由单质直接化合生成的是
①CuS ②FeS ③SO3 ④H2S ⑤FeCl2
A.①③⑤ B.①②③⑤
C.①②④⑤ D.全部
3.除去试管壁上附着的硫,可采用的方法是
A.通入氢气后加热
B.伸入灼热的铁丝
C.用水洗涤
D.用二硫化碳洗涤后再用水洗
... ... ...
硫及其化合物PPT,第三部分内容:02二氧化硫
知识梳理
1.实验探究
实验一:SO2的物理性质
现象:液面迅速____,最后充满试管。
结论:SO2有________气味,________溶于水。
实验二:SO2的化学性质
用水溶性实验所得溶液做下列实验
3.化学性质
(1)从物质分类的方面分析SO2性质
正反应:化学上通常把向生成物方向进行的反应叫做正反应。
逆反应:向反应物方向进行的反应叫做逆反应。
可逆反应:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。
(2)从元素化合价变化角度分析SO2性质
(3)SO2的特性——漂白性
可使某些有色物质(如品红溶液)生成不稳定的无色物质,若加热,可恢复原来的颜色。
4.用途
二氧化硫常用作漂白剂、杀菌消毒剂、食品添加剂。
深度思考
1.氯气和二氧化硫都能使品红溶液褪色,原理是否相同?若将等物质的量的氯气和二氧化硫气体相混合后漂白能力是否会增强?
提示 不同,氯气使品红溶液褪色是因为氯气与水反应生成的次氯酸具有强氧化性,可以将有色物质氧化成无色物质,此过程是不可逆的,而二氧化硫使品红溶液褪色是可逆的。若将等物质的量的氯气和二氧化硫气体相混合后,在溶液中发生反应SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。
2.可逆反应是在相同条件下能同时向正、反两个方向进行的反应。下列反应不属于可逆反应的是________。
3.三氧化硫具有酸性氧化物的通性。写出下列反应的化学方程式。
(1)三氧化硫与水剧烈反应生成硫酸
提示 SO3+H2O===H2SO4
(2)三氧化硫与碱(石灰乳)反应
提示 SO3+Ca(OH)2===CaSO4+H2O
(3)三氧化硫与氧化钙反应
提示 SO3+CaO===CaSO4
(4)三氧化硫通入氯化钡溶液中有沉淀生成
提示 SO3+BaCl2+H2O===BaSO4↓+2HCl
4.向盛有下列溶液的试管中分别通入SO2气体:①紫色石蕊溶液;②NaOH溶液(滴有酚酞溶液);③品红溶液;④溴水。
请回答下列问题:
(1)试管①中的现象是_________________,发生反应的化学方程式为____________________。
(2)试管②中的现象是__________,发生反应的化学方程式为______________________________,若继续通入过量的SO2,则发生反应的化学方程式为_____________________________。
(3)试管③中的现象是______________,若将吸收SO2的溶液加热,现象是_____________。
(4)试管④中的现象是__________。
(5)上述实验,SO2表现出酸性氧化物性质的是_____(填序号,下同),SO2表现出漂白性的是____,SO2表现出还原性的是____。
相关链接
(1)根据SO2分子中S的价态可知,SO2中的S在反应中既可得到电子也可失去电子,既具有氧化性又具有还原性。SO2的性质可总结为“三性一特性”:“三性”指氧化性(主要指SO2+2H2S===3S+2H2O)、还原性(能使溴水、酸性KMnO4溶液褪色)、酸性氧化物的通性;“一特性”指漂白性(能使品红溶液褪色,但加热后溶液又恢复红色)。
(2)特别提示
①褪色不都是漂白,有机色质(如纸张、布条)被氧化或因为发生化合反应而褪色称为漂白,无机离子或分子因为发生氧化还原反应而褪色不叫漂白,如SO2将MnO 还原为Mn2+,不是漂白。
②SO2的漂白是“化合型”漂白,即与有色物质化合生成无色不稳定化合物,与SO2是酸性气体、有还原性无关。SO2的漂白具有选择性,不能漂白酸碱指示剂。
跟踪强化
1.下列反应中,SO2作还原剂的是
A.SO2+NaOH===NaHSO3
B.SO2+H2O2===H2SO4
C.SO2+2H2S===3S+2H2O
D.2Mg+3SO2===S+2MgSO3
2.下列反应中,不能说明SO2是酸性氧化物的是
A.SO2+H2O H2SO3
B.SO2+2NaOH===Na2SO3+H2O
C.2SO2+O2 2SO3
D.SO2+CaO===CaSO3
3.下列变化可以说明SO2具有漂白性的是
A.SO2通入溴水中,溴水褪色
B.SO2通入酸性高锰酸钾溶液中,溶液的紫红色褪去
C.SO2通入品红溶液中,溶液的红色褪去
D.SO2通入滴有酚酞的氢氧化钠溶液中,溶液的红色褪去
... ... ...
关键词:人教版高中化学必修二PPT课件免费下载,硫及其化合物PPT下载,化工生产中的重要非金属元素PPT下载,硫和二氧化硫PPT下载,.PPT格式;