人教版(2019)化学必修第一册《元素周期表和元素周期律的应用》元素周期律PPT
展开
《元素周期表和元素周期律的应用》元素周期律PPT
第一部分内容:目标与素养:
1.知道元素周期表的简单分区。(宏观辨识)
2.进一步认识元素周期表是元素周期律的具体表现形式。(宏观辨识)
3.了解元素的原子结构、周期表中的位置与元素性质的关系。(宏观辨识与微观探析)
4.体会元素周期表和元素周期律在科学研究和工农业生产中的指导意义。(科学态度与社会责任)
... ... ...
元素周期表和元素周期律的应用PPT,第二部分内容:自主预习探新知
一、元素周期表的分区及元素化合价规律
请填写出图中序号所表示内容。
①___;②___;③___;④___;
⑤___;⑥___;⑦___;⑧___ 。
微点拨:①周期表的左下方是金属性最强的元素(钫),右上方是非金属性最强的元素(氟)。碱性最强的是FrOH,酸性最强的含氧酸是HClO4。
②由于元素的金属性和非金属性之间没有严格的界线,因此,位于分界线附近的元素既能表现出一定的金属性,又能表现出一定的非金属性。
③元素的化合价与元素在周期表中的位置之间关系
主族元素的最高正化合价,等于原子所能失去或偏移的最外层电子数;而非金属的负化合价则等于使原子达到8电子稳定结构所需得到的电子数。所以,非金属元素的最高正化合价和它的负化合价的绝对值之和等于8。即:a.最高正化合价=族序数=原子最外层电子数(O、F除外);b.最高正化合价+最低负化合价绝对值=8。
二、元素周期表和元素周期律的应用
1.根据同周期、同主族元素性质的递变规律判断元素性质的______(或______)。
2.应用于元素“______—______—______”的相互推断。
3.预测新元素
为新元素的发现,以及预测它们的______提供线索。
4.寻找新物质
(1)在金属与非金属分界处可以寻找______材料。
(2)研究____________附近元素,制造新农药。
(3)在______中寻找催化剂和耐高温、耐腐蚀的合金材料。
... ... ...
元素周期表和元素周期律的应用PPT,第三部分内容:核心突破攻重难
同一元素的“位、构、性”关系
元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
1.结构与位置互推是解题的基础
(1)掌握四个关系式
①电子层数=周期数。
②质子数=原子序数。
③主族元素原子最外层电子数=主族序数。
④主族元素的最高正价=族序数,最低负价=主族序数-8。
(2)熟练掌握周期表中的一些特殊规律
①各周期元素种类数(分别为2、8、8、18、18、32、32)。
②稀有气体元素原子序数(分别为2、10、18、36、54、86、118)和所在周期(分别在一到七周期)。
③同族上下相邻元素原子序数的关系(相差2、8、18、32、32)。
④同周期ⅡA族与ⅢA族元素原子序数差值(有1、11、25等情况)。
2.性质与位置互推是解题的关键
熟悉元素周期表中同周期、同主族元素性质的递变规律,主要包括:
(1)原子半径。
(2)元素的主要化合价。
(3)元素的金属性、非金属性。
(4)单质的氧化性、还原性。
(5)气态氢化物的稳定性。
(6)最高价氧化物对应水化物的酸碱性。
(7)金属从H2O或酸中置换H2的难易程度。
3.结构和性质的互推是解题的要素
(1)电子层数和最外层电子数决定元素原子的金属性和非金属性强弱。
(2)同主族元素最外层电子数相同,化学性质相似。
(3)正确推断原子半径和离子半径的大小及结构特点。
(4)判断元素金属性和非金属性强弱。
... ... ...
元素周期表和元素周期律的应用PPT,第四部分内容:当堂达标提素养
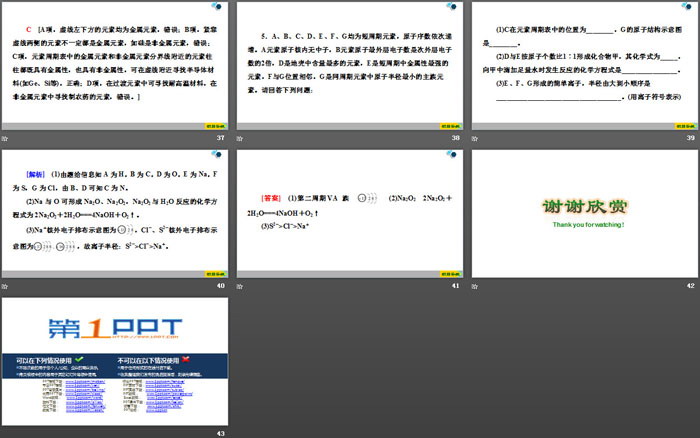
1.元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族元素的原子、最外层电子数相同,化学性质完全相同
B [位于周期表中金属与非金属分界线上的元素(如Al)既能表现金属性,又能表现非金属性,A错;H+最外层无电子,H-、Li+最外层只有两个电子,C错;同主族元素的原子,化学性质有相似性,但并不完全相同,D错;第三周期元素的最高正化合价由ⅠA~ⅦA族分别为+1、+2、+3、+4、+5、+6、+7价等于它所处的主族序数,B正确。]
2.科学家已正式将原子序数为114的元素命名为钅夫,下面关于它的原子结构和性质预测不正确的是( )
A.该元素原子的最外层电子数为4
B.其常见价态为+2、+4
C.它的金属性比铅强
D.它的原子半径比第115号元素的原子半径小
D [根据114号元素的原子序数,可推知该元素在周期表中位于第七周期,第ⅣA族,其与碳是同一主族元素,该元素最外层电子数为4,其有+2价、+4价,A、B项正确;114号元素与铅为同一主族元素,根据同主族元素从上到下金属性逐渐增强,可知该元素的金属性比铅强,C项正确;114号元素与115号元素位于同一周期,根据同周期元素原子半径逐渐减小可知,114号原子半径大于115号原子半径,D项不正确。]
3.第ⅡA族元素从第二周期到第六周期的元素分别是Be(铍)、Mg(镁)、Ca(钙)、Sr(锶)、Ba(钡)。下列关于ⅡA族元素预言可能正确的是( )
①常温下,单质铍能与水剧烈反应放出H2 ②常温下,单质钡能与水剧烈反应放出H2 ③Be(OH)2易溶于水 ④Ba(OH)2易溶于水 ⑤SrCO3易溶于水
A.①②③ B.③⑤ C.②④ D.①②③④⑤
C [同主族从上到下,金属性逐渐增强,与水反应越来越剧烈,即常温下,单质钡能与水剧烈反应放出H2,①错误,②正确;Mg(OH)2难溶于水,Ca(OH)2微溶于水,推出Be(OH)2难溶于水,③错误;Ba(OH)2是易溶于水的强碱,④正确;根据MgCO3、CaCO3、BaCO3难溶于水,因此SrCO3难溶于水,⑤错误。]
关键词:人教版高中化学必修一PPT课件免费下载,元素周期表和元素周期律的应用PPT下载,元素周期律PPT下载,.PPT格式;