人教版(2019)化学必修第一册《物质的量》海水中的重要元素―钠和氯PPT(第3课时物质的量浓度)
展开
《物质的量》海水中的重要元素—钠和氯PPT(第3课时物质的量浓度)
第一部分内容:学习目标
课程标准
1.了解物质的量浓度的含义和应用,体会定量研究对化学科学的重要作用。
2.能基于物质的量认识物质的组成及其化学变化,并运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
3.能配制一定物质的量浓度的溶液。
核心素养
1.变化观念:认识物质的量浓度在化学定量研究中的重要作用。
2.宏观辨识与微观探析:建立物质的量浓度的概念,基于物质的量浓度定量认识物质的组成及物质的化学变化。
3.科学探究:选择常见实验仪器、装置和试剂,配制一定物质的量浓度的溶液。
... ... ...
物质的量PPT,第二部分内容:知识点1 物质的量浓度及其计算
1.概念:__________的溶液里所含溶质B的__________,符号为_____,常用单位为_______或__________。
2.表达式:cB=nBV,其中的“V”指的是溶液的体积,而非溶剂的体积。
3.简单计算
(1)已知溶液中某种离子的浓度,求其他离子的浓度
溶液中阴、阳离子的物质的量浓度之比=化学组成中的离子个数之比。
例如:Na2SO4溶液中,c(SO2-4)=1mol•L-1,则c(Na+)=__________,c(Na2SO4)=__________。
(2)已知一定体积的溶液中溶质的质量计算浓度
例如:2.0gNaOH固体溶于水配成500mL溶液,则该溶液的浓度为________________。
(3)标准状况下,一定体积的气体溶于水形成VL溶液计算浓度
例如:标准状况下,11.2LHCl气体溶于水配成200mL溶液,则该溶液的浓度为________________。
重难点拨
1.物质的量浓度与溶质的质量分数的换算
(1)换算公式:cB=1000ρwMmol•L-1
M:溶质B的摩尔质量(单位:g•mol-1);ρ:溶液密度(单位:g•mL-1);w:溶质的质量分数。
2.溶液稀释与混合的计算
(1)浓溶液稀释
①溶质的物质的量不变:c(浓)•V(浓)=c(稀)•V(稀);
②溶质的质量不变:m(浓)•w(浓)=m(稀)•w(稀);
③溶液的质量守恒:m(稀)=m(浓)+m(水)(体积一般不守恒)。
(2)相同溶质的两溶液混合
①溶质的物质的量不变:c1V1+c2V2=c(混)•V(混);
②溶质的质量不变:m1w1+m2w2=m(混)•w(混)。
活学活用
1.1mol•L-1硫酸溶液的含义是( )
A.1L水中含有1mol硫酸
B.1L溶液中含有1molH+
C.将98g硫酸溶于1L水所配成的溶液
D.从1L该溶液中取出500mL后,剩余溶液的浓度仍为1mol•L-1
2.下列说法正确的是( )
A.1L水中溶解1molNaCl所形成溶液的物质的量浓度为1mol•L-1
B.标准状况下,22.4LHCl气体溶于1L水中形成的溶液的体积为1L
C.标准状况下,将33.6LHCl气体溶于水形成1L溶液,其物质的量浓度是1.5mol•L-1
D.1molCaCl2溶于水形成1L溶液,所得溶液中c(Cl-)等于1mol•L-1
... ... ...
物质的量PPT,第三部分内容:知识点2 配制一定物质的量浓度的溶液
1.容量瓶:用于精确配制一定物质的量浓度的溶液。
(1)构造特点:细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞,标有______和容积。
(2)常用规格:50mL、100mL、250mL、500mL、1000mL。
(3)注意事项
①容量瓶瓶塞须用结实的细绳系在瓶颈上,以防止损坏或丢失。
②使用前,首先要检查容量瓶是否完好,瓶口处是否漏水。
查漏方法:向容量瓶中注入一定量水,盖好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立,观察是否漏水。如不漏水,将瓶正立并将塞子旋转180°后塞紧,再把瓶倒立,观察是否漏水。如不漏水,该容量瓶才能使用。
③不能用容量瓶溶解固体或稀释浓溶液。
④容量瓶不能做反应容器或长期存放溶液。
⑤选择容量瓶遵循“大而近”原则,即所配溶液的体积等于或略小于容量瓶的容积。
⑥容量瓶使用完毕,应洗净、晾干。(玻璃磨口瓶塞应在瓶塞与瓶口处垫一张纸条,以免瓶塞与瓶口粘连)
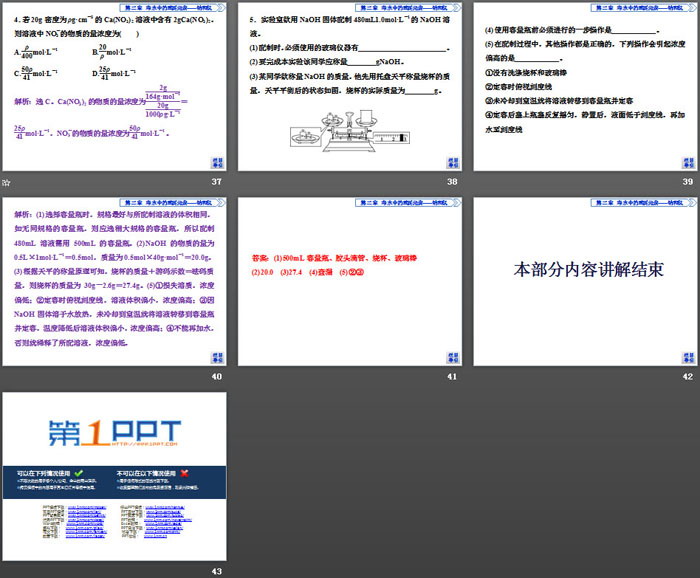
2.配制一定物质的量浓度的溶液(以配制100mL1.00mol•
L-1NaCl溶液为例)
(1)主要仪器:托盘天平、药匙、烧杯、量筒、____________、____________、________________。
(2)实验步骤
重难点拨
配制一定物质的量浓度溶液的误差分析
1.原理依据
根据cB=nBV=mM•V判断。其他条件不变时:
(1)使m增大(或减小)的因素,导致cB偏大(或偏小)。
(2)使V增大(或减小)的因素,导致cB偏小(或偏大)。
2.误差分析
3.定容时仰视或俯视刻度线产生的误差图解
(1)仰视刻度线(图甲)。由于操作时是以刻度线为基准加水,从下向上看,最先看见的是刻度线,刻度线低于液面的实际高度,故加水量偏多,导致溶液体积偏大,浓度偏小。
(2)俯视刻度线(图乙)。与仰视刻度线恰好相反,刻度线高于液面的实际高度,故加水量偏少,导致溶液体积偏小,浓度偏大。
活学活用
1.下列关于容量瓶的说法不正确的是( )
A.容量瓶上一般标有规格、温度和刻度线
B.容量瓶在使用前要检查是否漏水
C.可将浓溶液直接在容量瓶中稀释
D.容量瓶不能长时间盛放所配制的溶液,应及时分装在试剂瓶中
2.用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
3.下列配制的溶液浓度偏高的是( )
A.配制盐酸用量筒量取盐酸时俯视读数
B.配制盐酸定容时,仰视容量瓶刻度线
C.称量4.0gNaOH配制1000mL0.1mol•L-1NaOH溶液时,砝码错放在左盘
D.NaOH溶解后未经冷却即注入容量瓶,再加水至刻度线
... ... ...
物质的量PPT,第四部分内容:合格考训练
1.小明体检的血液化验单中,葡萄糖为5.9mmol/L。表示该体检指标的物理量是( )
A.物质的量 B.物质的量浓度
C.质量分数 D.摩尔质量
2.下列溶液中溶质的物质的量浓度为0.1mol•L-1的是( )
A.1L含4gNaOH的溶液
B.1L含0.1gNaOH的溶液
C.0.5L含0.2molH2SO4的溶液
D.将98g的H2SO4倒入1L水中
3.实验室中需要配制950mL2mol•L-1的NaOH溶液,配制时应选用的容量瓶的规格和称取的NaOH的质量分别是( )
A.950mL,96.0g B.500mL,80.0g
C.1000mL,80.0g D.1000mL,76.0g
... ... ...
关键词:人教版高中化学必修一PPT课件免费下载,物质的量PPT下载,海水中的重要元素钠和氯PPT下载,物质的量浓度PPT下载,.PPT格式;